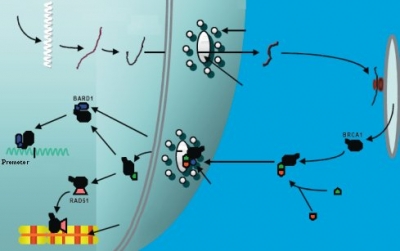
Las enzimas PARP (Poly ADP Ribose Polymerase) son un grupo de proteínas involucradas en la reparación del DNA de cadena simple. Las proteínas BRCA1 y BRCA2 son enzimas involucradas en diversas funciones fisiológicas celulares, una de sus funciones primordiales es la de activarse cuando ocurre un daño del DNA con rotura de ambas hebras del DNA colaborando en la reparación (recombinación homóloga).
Los fármacos inhibidores de la PARP son potencialmente útiles en los pacientes que presentan mutaciones en BRCA1 o BRCA2 dado que en dichos pacientes, la inhibición de dos mecanismos de reparación del DNA diferentes puede conducir a la célula tumoral a la inestabilidad genética y muerte celular, fenómeno conocido como letalidad sintética. Sin embargo, en los últimos años se han sugerido otros mecanismos de acción asociado a los diferentes inhibidores de la PARP no del todo comprendidos. La presencia de la vía NHEJ (non-homologous end joining) intacta, la presencia de mutaciones en RAD51C, RAD51D o células deficientes en PTEN se asocian a mayor sensibilidad a los inhibidores de la PARP en estudios preclínicos.
Los pacientes potencialmente beneficiados a ser tratados con los inhibidores de la PARP incluyen aquellos con mutaciones germinales o somáticas de BRCA1/2 y no sólo con cáncer de mama u ovario sino también con melanoma, cáncer de próstata y páncreas. También se incluyen aquellos cánceres que presentan deficiencias genéticas de la vía de la recombinación homóloga (ej: mutaciones de ATM/ATR, pérdida de PTEN) o silenciamiento epigenético (por ej. metilación de BRCA1 o de RAD1C).
Existen diferentes potenciales biomarcadores predictivos de respuesta a los inhibidores de la PARP. Las mutaciones somáticas o germinales de BRCA1/2 son buenos marcadores predictivos ya establecidos. Otros potenciales biomarcadores que deben ser validados incluyen la determinación de BRCA1 por inmunohistoquímica, los niveles de H2AX (proteína histona), la determinación de focos de RAD51 por inmunofluorecencia o la pérdida de función de la proteína 53bp1 de la vía de NHEJ.
Los mecanismos de resistencia a los inhibidores de la PARP incluyen la restauración de la función de la recombinación homóloga a través del restablecimiento de la función de BRCA (mutaciones secundarias en BRCA) o por supresión de la vía NHEJ. Otro mecanismo secundario de resistencia es la expulsión del fármaco fuera de la célula tumoral mediada por el trasportador de membrana, la glicoproteína-P.
Los inhibidores de la PARP han sido extensamente estudiados en cáncer de mama y ovario y se han reportado significativas respuestas en pacientes con mutaciones germinales de BRCA. Además existe evidencia clínica que sugiere la potencial utilidad clínica en cáncer de ovario seroso de alto grado esporádico y en tumores con deficiencia en la reparación del DNA como cáncer de próstata, endometrio y páncreas. Diversos ensayos clínicos fase I, II y III se encuentran en desarrollo con diferentes moléculas inhibidores de la PARP.
Entre el 15-18% de las pacientes con cáncer de ovario está relacionado con mutaciones de BRCA1/2 y alrededor de la mitad de los carcinomas serosos de alto grado de ovario presentan alteraciones genéticas germinales o somáticas o modificaciones epigenéticas de la vía de la recombinación homóloga. Diferentes fármacos inhibidores de la PARP, de administración oral, se encuentran en estudio en cáncer de ovario en estudios fase I, II y III.
En el 2012 Kaye y col. publicó en el J Clin Oncol un estudio de Fase II que comparó 2 dosis diferentes de olaparib (200 mg/día 2 veces por día o 400 mg/día 2 veces por día v. oral) versus doxorrubicina liposomal (50 mg/m2 cada 28 días iv.) en cáncer de ovario recurrente con mutaciones de BRCA1 o BRCA2. La SLP fue similar en las tres ramas sin diferencias estadísticamente significativas entre las ramas de olaparib y doxorrubicina liposomal.
Ledermann y col. publicó en el N Eng J Med un estudio clínico que comparó olaparib 400 mg/día 2 veces por día versus placebo como terapia de mantenimiento en pacientes recaídas sensibles a platino. La SLP favoreció a la rama de olaparib con un HR=0.35 (IC 95%, 0.25-0.49) y con una p<0.00001 pero sin diferencia en la sobrevida global. En el análisis del subgrupo con mutaciones de BRCA germinales o somáticas, la SLP favoreció enormemente a la rama de olaparib por sobre el placebo (11,2 meses vs. 4,3 meses respectivamente; HR=0.18 y p<0.00001) con un 82% de reducción en el riesgo de progresión o muerte.
Oza y col. presentaron en ASCO 2012 un estudio fase II en pacientes con carcinoma seroso de ovario recurrente sensible a platino (> de 6 meses del último régimen de platino administrado). Se comparó olaparib asociado a carboplatino + paclitaxel x 4-6 ciclos seguido de olaparib 400 mg 2 veces por día en la etapa de mantenimiento (rama experimental) vs. carboplatino + paclitaxel 4-6 cursos (brazo control). La rama experimental tuvo una SLP de 12.2 meses versus 9.6 meses con el esquema de quimioterapia sola (HR0 0.51; IC 95% 0.34-0.77; p=0.0012).
También se presentaron en ASCO 2014 los resultados de otro estudio Fase II randomizado que comparó la combinación de olaparib + cediranib (agente antiangiogénico) vs. olaparib monodroga en pacientes con cáncer de ovario recurrente sensibles a platino. Dicho estudió favoreció a la rama de combinación con una importante ventaja en SLP de 17.7 meses vs. 9 meses (HR=0.42; IC 95% 0.23-0.76). En el análisis de los subgrupos, la ventaja en eficacia determinado por la SLP fue mayor en pacientes sin mutación de BRCA (cediranib/olaparib 16.5 meses vs. olaparib 5.7 meses; HR=0.32; p=0.008)
En conclusión, los inhibidores de la PARP han demostrado eficacia en cáncer de ovario como terapia de mantenimiento o tratamiento de la enfermedad activa. Presenta un adecuado perfil de toxicidad y el rol de la asociación con otras modalidades terapéuticas como quimioterapia o agentes antiangiogénicos está por determinarse. No se ha demostrado aún ventaja en la sobrevida global con los inhibidores de la PARP en estudios randomizados.
A su vez, la potencial indicación en otros tumores con alteración de la recombinación homóloga también se encuentra en estudio. Bella Kaufman y col. presentaron en ASCO 2013 un estudio fase II con 300 pacientes con BRCA 1 o BRCA 2 mutados progresados a la terapia standard y tratados con olaparib 400 mg 2 veces por día.
En dicho estudio, los tumores de ovario, mama, páncreas y próstata con mutaciones de BRCA1 o BRCA2 tuvieron respuestas objetivas del 31%, 13%, 22% y 50% respectivamente.
Finalmente, diferentes preguntas quedan por definir el rol de los inhibidores de la PARP en el tratamiento de cáncer de ovario. ¿Se deben utilizar solos o asociados a quimioterapia o agentes antiangiogénicos? ¿En qué etapa de la enfermedad deberían utilizarse: como terapia de mantenimiento, en la recurrencia o en el tratamiento primario?
Los desafíos pendientes incluyen identificar los mecanismos de resistencia, biomarcadores predictivos de respuesta, identificar tumores esporádicos con deficiencia de la recombinación homóloga y el desarrollo de efectivas y tolerables combinaciones.
Fuente: Medcenter Expert ViewPoint,06.02.15