| Introducción |
Las tasas de infección por el virus de la hepatitis B (VHB) y el virus de la hepatitis C (VHC) entre mujeres embarazadas en los Estados Unidos en 2019 se informaron en 0,09% y 0,1% a 3,6%, respectivamente.1, 2 Las tasas de infección materna por VHB aumentaron un 5,5% anual desde 1998.1 La transmisión vertical puede ocurrir en casos de infección materna aguda o crónica por VHB o VHC.1, 3, 4, 5
Los recién nacidos infectados con el VHB al nacer corren un riesgo importante de desarrollar una infección crónica por el VHB y la morbilidad asociada.3 Se actualizaron las pautas recientes para la atención pre parto en personas con hepatitis viral crónica.3,5
Varios estudios han demostrado oportunidades para mejorar el cumplimiento de las pautas de atención antes del parto y del recién nacido destinadas a reducir la transmisión vertical.3,4 El objetivo de este artículo es revisar la prevalencia, el diagnóstico y el manejo de la hepatitis viral durante los períodos de pre parto y neonatal.
| Prevalencia |
El informe de progreso global de la Organización Mundial de la Salud de 2019 sobre la hepatitis viral informó que 296 millones de personas vivían con infección crónica por VHB y 58 millones tenían infección crónica por VHC.3 En 2019, 6 millones de niños menores de 5 años vivían con infección crónica por VHB en todo el mundo.3
En los Estados Unidos, el número estimado de bebés nacidos de personas con HBsAg positivo aumentó un 33% entre 1994 y 2008.4 Durante la última década, las tasas de VHC en el embarazo también aumentaron debido al uso de drogas por vía intravenosa.5
La hepatitis viral sigue siendo una de las infecciones virales más frecuentes y potencialmente graves que pueden ocurrir en una paciente embarazada.5 Sin vacunación posnatal e inmunoprofilaxis, la infección crónica por VHB ocurre en hasta el 90 % de los lactantes infectados por VHB al nacer.5,6,7,8 La mayoría de las infecciones crónicas por VHB son causadas por transmisión de madre a hijo (MTCT, por sus siglas en inglés)3,5; por lo tanto, la vacunación neonatal y la inmunoprofilaxis siguen siendo formas críticas de reducir la infección neonatal, así como la futura carga de infecciones crónicas por VHB.3,5,9
Otras oportunidades para la prevención de la infección crónica por VHB ocurren en la primera infancia; si la infección ocurre entre 1 y 5 años de edad, el riesgo de desarrollar infección crónica por VHB es del 25% al 50%, mientras que si se adquiere después de los 5 años de edad hasta la edad adulta, el riesgo de infección crónica por VHB es menor, del 5% al 10%.10
| Tamizaje y diagnóstico de la infección por VHB Y VHC durante el embarazo |
El VHB es un virus de ADN parcialmente bicatenario envuelto de la familia Hepadnaviridae con 10 genotipos.11 El VHB contiene 3 antígenos principales, a saber, el antígeno de superficie de la hepatitis B (HBsAg), el antígeno central de la hepatitis B (HBcAg) y el antígeno e de la hepatitis B (HBeAg). Se recomienda la detección universal del VHB en mujeres embarazadas durante cada embarazo utilizando HBsAg sérico, independientemente del estado de vacunación contra el VHB de la paciente.12
Si la prueba de detección de HBSAg es positiva para la infección por hepatitis, la identificación del estadio de la enfermedad se basa en la presencia o ausencia de varios antígenos y anticuerpos de la hepatitis B en sangre. Un HBsAg positivo indica una infección aguda o crónica y presagia un riesgo de transmisión vertical al recién nacido.
Se utilizan marcadores serológicos adicionales para diagnosticar la infección crónica o aguda por VHB, la susceptibilidad al VHB, la infección previa o la vacunación previa.13
La presencia de HBeAg indica un alto nivel de infectividad y replicación viral activa.
El VHC es un virus ARN de la familia Flaviviridae. La detección se realiza mediante la prueba de anticuerpos contra el virus de la hepatitis C. Al igual que con el VHB, muchas organizaciones, incluidos los Centros para el Control y la Prevención de Enfermedades, la Sociedad de Medicina Materno Fetal y el Colegio Estadounidense de Obstetras y Ginecólogos (ACOG, por sus siglas en inglés), actualmente recomiendan que todas las mujeres embarazadas se hagan pruebas de detección del VHC durante cada embarazo.
Si el anticuerpo de la hepatitis C es positivo, el paciente debe someterse a una prueba de ARN del VHC. Si una paciente embarazada tiene anticuerpos contra la hepatitis C con un nivel negativo de ARN del VHC, esto es compatible con una infección eliminada o tratada. Sin embargo, si los pacientes tienen ARN del VHC en la sangre, se los considera infecciosos.14
Las pruebas de detección de VHB y VHC durante cada embarazo brindan una oportunidad para que las pacientes infectadas que de otro modo no tendrían acceso a la atención médica regular se sometan a pruebas y reciban referencias y tratamiento de subespecialidades.
| Hepatitis viral aguda y crónica en el embarazo |
Afortunadamente, la infección aguda por hepatitis sintomática en el embarazo es menos común que la infección crónica.5 En ausencia de enfermedad grave, las pacientes embarazadas con hepatitis viral aguda pueden recibir tratamiento ambulatorio. Las indicaciones de hospitalización incluyen encefalopatía, coagulopatía o debilitamiento grave secundario a dolor abdominal, fiebre, diarrea o mialgias.5
Los pacientes con infección aguda por VHB deben limitar la actividad y evitar traumatismos en la parte superior del abdomen.5 Se ha notificado insuficiencia hepática aguda debida a infección por VHB y VHC durante el embarazo.15 Las pacientes embarazadas que presenten hepatitis grave deben ser evaluadas para detectar la presencia del virus de la hepatitis E porque, si está presente, es más probable que las pacientes progresen a una hepatitis aguda fulminante, que conlleva una tasa de mortalidad de hasta el 30%.16
Si una paciente embarazada es positiva para HBsAg, se deben realizar pruebas serológicas adicionales, incluido HBeAg (para evaluar la alta infectividad), enzimas hepáticas y carga viral del VHB. Se aconseja la derivación a hepatología o gastroenterología durante el control prenatal, especialmente si el HBeAg es positivo o la carga viral es alta (>6-8 log10 copias/mL).17,18
En el tercer trimestre, entre las 28 y 32 semanas de gestación, se debe volver a realizar la prueba de carga viral a la paciente, ya que si la carga viral es alta estaría indicado el tratamiento materno. Kushner y colaboradores revisaron recientemente el cumplimiento de estas recomendaciones en los Estados Unidos,19 y encontraron un cumplimiento subóptimo, con un 62% de los pacientes que recibieron la remisión adecuada a atención de subespecialidad.
Solo el 51% de los pacientes tuvieron mediciones repetidas de la carga viral del VHB entre las semanas 28 y 32 de gestación, y el 68% de los pacientes con una carga viral superior a 6 a 8 log10 copias/ml recibieron tratamiento antiviral adecuado.19
La carga viral de la hepatitis B es un factor clave para la transmisión de madre a hijo del VHB y, por lo tanto, la investigación se ha centrado en los tratamientos antivirales durante el embarazo para reducir la carga viral y disminuir la probabilidad de transmisión vertical al recién nacido. Estudios recientes han demostrado tanto la seguridad como la eficacia de tenofovir en el embarazo para reducir la transmisión vertical del VHB.20,21
Un metanálisis de ensayos controlados aleatorios del uso de tenofovir en el embarazo para tratar la infección por VHB demostró una reducción del 90% en la probabilidad de positividad para HBsAg en bebés entre los 6 y los 12 meses de edad.20 Con base en esta investigación, las agencias nacionales recomiendan el tratamiento con tenofovir en el tercer trimestre para embarazadas con alto riesgo de transmisión vertical del VHB, que se define como ADN del VHB mayor de 6 a 8 log10 copias/mL o un HBeAg positivo.12
Actualmente, no existen regímenes antivirales contra el VHC aprobados para su uso durante el embarazo debido a problemas de teratogenicidad.5 Esta guía puede cambiar con más experiencia con los regímenes antivirales de acción directa más nuevos. El manejo del VHC durante el período pre parto tiene como objetivo establecer la atención con un hepatólogo para garantizar que se inicie el tratamiento posparto.
Cuando sea factible, todas las mujeres en edad reproductiva con infección conocida por VHC deben recibir terapia antiviral previa a la concepción antes de considerar el embarazo para reducir el riesgo de transmisión vertical. Además, es importante asesorar a los pacientes y sus parejas masculinas sobre la teratogenicidad de la ribavirina en estudios con animales y registros humanos disponibles para que eviten la concepción cuando toman este medicamento contra el VHC.22
> Pruebas invasivas
Las pruebas prenatales invasivas (es decir, amniocentesis, muestreo de vellosidades coriónicas) para pacientes con hepatitis viral crónica requieren asesoramiento y toma de decisiones compartida. Aunque las tasas de transmisión materno infantil del VHB relacionadas con las pruebas prenatales invasivas son en general bajas, algunos estudios han mostrado mayores tasas de transmisión junto con una mayor carga viral y positividad para HBeAg.23, 24
Los datos sobre el riesgo de transmisión vertical del VHC secundaria a pruebas prenatales invasivas son insuficientes. Los datos disponibles no muestran un mayor riesgo de transmisión del VHC.24 Algunos expertos prefieren la amniocentesis al muestreo de vellosidades coriónicas en mujeres con infección por VHC.5 Es probable que el riesgo de transmisión del VHC aumente en personas con una carga viral alta o con coinfección por el virus de la inmunodeficiencia humana (VIH).24
> Modalidad del parto y atención intraparto
Dada la falta de ensayos controlados aleatorios que evalúen el impacto de la modalidad del parto en la transmisión madre a hijo del VHB o el VHC, las pautas actuales del ACOG no recomiendan el parto por cesárea únicamente para reducir la transmisión vertical.5,12
Un metanálisis de estudios retrospectivos demostró una reducción en la transmisión vertical del VHB en pacientes que se sometieron a partos por cesárea en comparación con partos vaginales25; sin embargo, los autores reconocen las limitaciones de sus datos retrospectivos. De manera similar, se ha sugerido evitar los electrodos en el cuero cabelludo fetal y prevenir la ruptura prolongada de membranas para reducir la transmisión materno infantil del VHB; sin embargo, faltan datos, particularmente en recién nacidos en riesgo tratados adecuadamente con inmunoglobulina contra la hepatitis B (HBIG) y vacunación oportuna.11, 26, 27
| Riesgo fetal y neonatal de hepatitis viral |
La mayoría de los casos de transmisión vertical del VHB ocurren intraparto durante el trabajo de parto y el parto.5 Menos del 2% de los casos de VHB transmitidos verticalmente ocurren en el útero.14
Los factores de riesgo para la infección intrauterina por VHB antes del período intraparto incluyen positividad de HBeAg en suero materno, trabajo de parto prematuro, carga viral alta e infección aguda durante el embarazo.28
Entre la minoría de pacientes con infección aguda por VHB durante el embarazo, existe una probabilidad del 10% de transmisión intrauterina si la infección aguda ocurre en el primer trimestre y una probabilidad del 90% de transmisión intrauterina si la infección aguda ocurre en el tercer trimestre.5
Los recién nacidos con mayor riesgo de transmisión madre a hijo son aquellos nacidos de pacientes con HBeAg positivo y una carga viral alta. Sin profilaxis posterior a la exposición, entre el 70% y el 90% de los lactantes se infectarán perinatalmente con el VHB si la madre es positiva para HBsAg y HBeAg.29 Este riesgo disminuye del 5% al 20% si la madre es HBsAg positiva y HBeAg negativa.14
Las complicaciones a largo plazo son poco comunes en niños con infección crónica por VHB, pero la cirrosis puede ocurrir en 1% a 5% y el carcinoma hepatocelular puede ocurrir en 0.5%.30 Algunos estudios de China han demostrado que la infección materna crónica por VHB puede estar asociada con un mayor riesgo de resultados perinatales adversos; sin embargo, esto no se ha replicado en la población de los Estados Unidos.31, 32, 33
El riesgo general de transmisión vertical de la infección por el VHC es del 2% al 8%.5,34
La probabilidad de transmisión vertical se correlaciona con la carga viral materna del VHC en el momento del nacimiento o cerca de él.14 En pacientes con carga viral negativa del VHC, la transmisión vertical es rara.5 También existe un mayor riesgo de transmisión madre a hijo del VHC con la coinfección por el VIH.5
Un estudio también ha demostrado una mayor probabilidad de transmisión vertical del VHC con el uso de la monitorización del cuero cabelludo fetal y si la ruptura de las membranas dura más de 6 horas.14 Un estudio en los Estados Unidos ha demostrado un mayor riesgo de resultados perinatales adversos, incluidos partos prematuros, bebés con bajo peso al nacer y anomalías congénitas, aunque estos riesgos se confunden con condiciones como el uso activo de drogas ilícitas o el tabaquismo.35
Se ha demostrado que la hepatitis C aumenta el riesgo de colestasis intrahepática del embarazo, que también se asocia con un mayor riesgo de resultados perinatales adversos, incluido el parto prematuro, la aspiración de meconio y, en ocasiones, la muerte fetal, en particular con niveles elevados de ácidos biliares.36
| Cuidado del recién nacido expuesto a VHB o VHC |
Aunque existen varias estrategias maternas para reducir la transmisión materno infantil del VHB, el tratamiento neonatal oportuno con vacunación contra el VHB y HBIG es la forma más eficaz de minimizar la infección neonatal por VHB en los recién nacidos en riesgo.3,5,14 Este tratamiento combinado reduce significativamente el riesgo de infección crónica por VHB en aproximadamente un 90%, incluso para aquellos bebés con mayor riesgo de adquisición vertical del VHB.
Cuando tanto la vacunación inicial como la inmunoprofilaxis se proporcionan dentro de las 12 horas posteriores al nacimiento, las tasas de infección perinatal oscilan entre el 0,7% y el 1,1%.7,8 Si la carga viral materna es extremadamente alta (niveles de ADN del VHB > 6–8 log10 copias/mL), pueden ocurrir casos de infección avanzada incluso con profilaxis posnatal.14
Las pautas actuales recomiendan que todos los bebés nacidos de pacientes embarazadas con HBsAg positivo deben recibir tanto la vacuna contra la hepatitis B como la HBIG dentro de las 12 horas posteriores al nacimiento. Para los lactantes que pesan menos de 2000 g, esta primera dosis de vacuna no se cuenta en el calendario de vacunación contra la hepatitis B de 3 dosis.14
Los recién nacidos de embarazadas con estado desconocido de HBsAg deben recibir la vacuna dentro de las 12 horas posteriores al nacimiento. En este escenario, la HBIG debe administrarse dentro de las 12 horas posteriores al nacimiento si el recién nacido pesa menos de 2000 g debido a la menor eficacia de la vacuna para los recién nacidos con pesos más bajos al nacer; para lactantes con peso al nacer superior a 2000 g, se debe administrar HBIG dentro de los 7 días si el estado de HBsAg de la madre es positivo, a los 7 días de edad si el estado de VHB de la madre sigue sin conocerse, o al alta hospitalaria si el estado de la madre sigue sin conocerse.14
Se recomiendan pruebas de seguimiento en niños nacidos de mujeres con HbsAg positivo entre los 9 y los 12 meses de edad (es decir, después de completar la serie de vacunas) con pruebas de anticuerpos anti-HBs (la presencia demuestra inmunidad) y HBsAg. Si la concentración de anticuerpos anti-HBs del bebé es mayor o igual a 10 mIU/mL y el HBsAg es negativo, el bebé no está infectado y se considera inmune.14
Si la concentración de anticuerpos anti-HBs es inferior a 10 mUI/mL y el HBsAg es negativo, el bebé debe recibir otra vacuna contra el VHB y volver a analizarse 1 a 2 meses después de esta cuarta dosis; si los anticuerpos anti-HBs son entonces mayores o iguales a 10 mIU/mL, el lactante no está infectado y se encuentra adecuadamente protegido.14 Para aquellos bebés que continúan teniendo niveles bajos de anticuerpos anti-HBs, se deben administrar 2 vacunas adicionales contra el VHB con 8 semanas de diferencia.14 Alternativamente, los bebés con anticuerpos anti HBs bajos entre los 9 y los 12 meses de edad pueden recibir una segunda serie de vacunas contra el VHB.14
La recomendación actual para la prueba de los bebés expuestos prenatalmente al VHC es realizar la prueba de anticuerpos a los 18 meses de edad o después.14 Si no es probable que se realicen las pruebas en ese momento o si la familia prefiere tener una evaluación más temprana del estado del VHC del niño, las pruebas con ARN del VHC se pueden realizar entre los 2 y los 6 meses de edad, con un seguimiento prueba de anticuerpos a los 18 meses de edad. 14
Las pruebas tempranas de anticuerpos contra el VHC no son confiables porque los anticuerpos maternos pueden persistir en los bebés durante 18 meses.14 Los niños que tengan anti-HCV positivo a los 18 meses de edad o después deben someterse a una prueba de ARN después de los 3 años para confirmar la infección crónica por hepatitis C.
El tratamiento está disponible para niños mayores de 3 años que tienen VHC crónico.37 A pesar de estas recomendaciones para las pruebas, Lopata y colaboradores encontraron que en una gran cohorte de Tennessee de 2005 a 2014, menos del 25% de todos los bebés expuestos al VHC fueron evaluados antes de los 2 años, lo que demuestra un área significativa de mejora en la detección.38
| Lactancia materna |
No existen contraindicaciones para la lactancia materna en pacientes con infección crónica por VHB o VHC en ausencia de infección concurrente por VIH.39,40
Aunque se ha identificado HBsAg en la leche materna de mujeres que dieron positivo para HBsAg, los estudios de Taiwán e Inglaterra encontraron que esto no conduce a un aumento significativo del riesgo de infección en los bebés.14
Similar al VHB, el ARN del VHC y los anticuerpos contra el VHC se han encontrado en la leche materna de madres con infección por VHC, pero no se ha encontrado que la lactancia materna afecte el riesgo de infección por VHC en bebés nacidos de madres VIH negativas.14
La Academia Estadounidense de Pediatría recomienda que las mujeres con infección por VHC deben abstenerse temporalmente de amamantar si sus pezones están agrietados o sangrando. 14
| Resumen |
| • Las infecciones por VHB y VHC siguen siendo una de las principales causas de infección viral y las tasas están aumentando.3
• Todas las pacientes embarazadas deben someterse a pruebas de detección tanto del VHB como del VHC.5 • Si se determina que las pacientes embarazadas son positivas para el VHB o el VHC, es necesario realizar más pruebas para determinar la necesidad de referirlas a hepatología y la candidatura para el tratamiento materno del VHB durante el embarazo.18 • Para pacientes embarazadas con VHB conocido, la carga viral debe obtenerse en el tercer trimestre (28–32 semanas de gestación) y la terapia antirretroviral debe iniciarse si la carga viral es >6–8 log10 copias/mL.12 • Existe el riesgo de transmisión vertical, pero en pacientes con infección conocida por VHB o VHC, aún se recomienda el parto vaginal y la lactancia a menos que existan otras contraindicaciones. 5, 12 • Se recomienda el tratamiento neonatal con vacunación contra HBV y HBIG para todos los bebés nacidos de mujeres embarazadas infectadas con HBV. 4, 7 • Todos los bebés nacidos de personas infectadas con el VHC deben someterse a pruebas de anticuerpos a los 18 meses de edad o después.37 • Conocer los efectos sobre el feto y/o el recién nacido de otras infecciones maternas (p. ej. malaria) y su manejo. |
> Interpretación de los resultados de las pruebas de Hepatitis B
Las pruebas serológicas de la hepatitis B (HBV) implican la medición de varios antígenos y anticuerpos específicos. Diferentes marcadores serológicos o combinaciones de marcadores se utilizan para identificar diferentes fases de la infección por HBV para determinar si un paciente tiene una infección por VHB aguda o crónica, es inmune al VHB como resultado de una infección o vacunación previa, o es susceptible
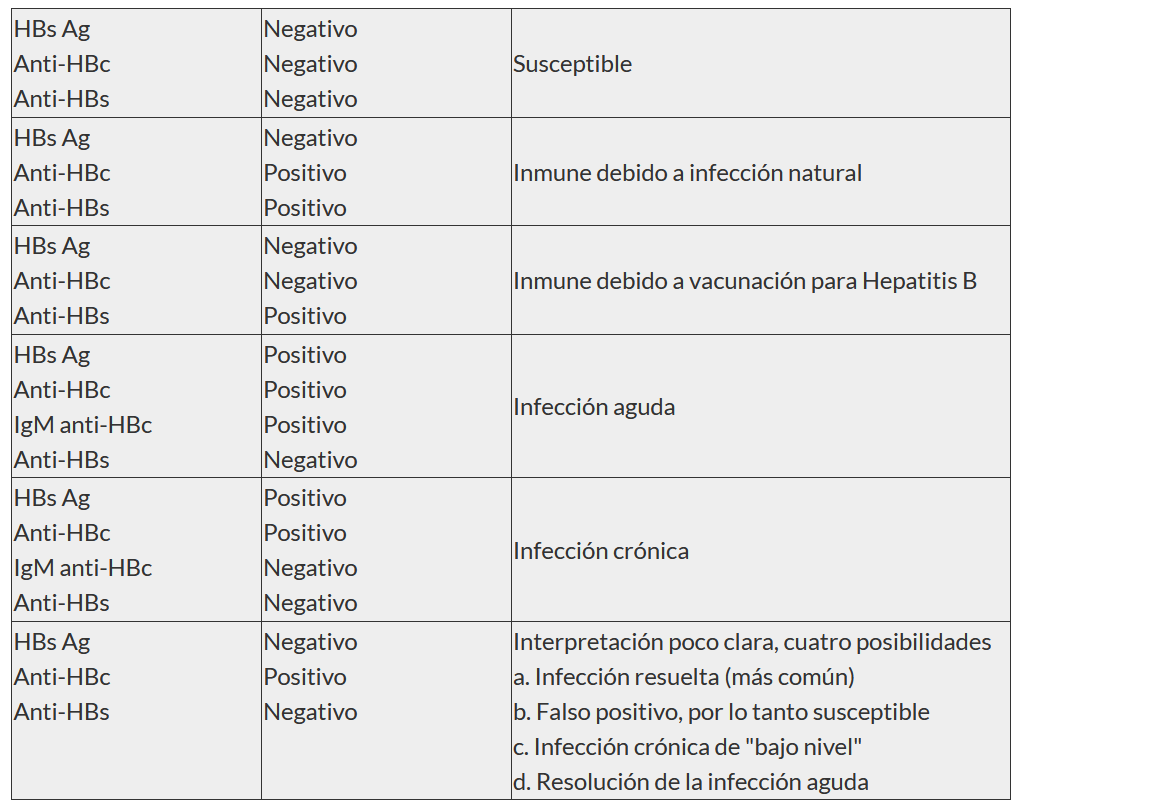
> Antígeno de superficie de Hepatitis B (HBs Ag)
Es una proteína de superficie del VHB. Puede detectarse en altos niveles en suero en infección aguda o crónica. La presencia del HBs Ag indica que el sujeto está infectado. El cuerpo normalmente produce anticuerpos contra HBs Ag como parte de la respuesta inmune normal a la infección.
El HBs Ag es el antígeno usado como marcador de vacuna anti Hepatitis B
> Anticuerpo de superficie de Hepatitis B (Anti-HBs)
Su presencia se interpreta como recuperación e inmunidad contra la infección contra hepatitis B. Anti-HBs se desarrolla en quien ha sido vacunado con éxito contra la hepatitis B.
Anticuerpo anti-core de Hepatitis B total (Anti-HBc)
Aparece al inicio de los síntomas en la hepatitis B aguda y persiste de por vida. Su presencia indica infección previa o en curso con hepatitis B en un período de tiempo indefinido.
Anticuerpo IgM contra el antígeno central de la hepatitis B (IgM Anti HBc)
Su presencia indica infección reciente o aguda con el virus de la Hepatitis B
| Comentario |
En los últimos años se ha detectado un aumento considerable de las tasas de bebés nacidos de personas con infección crónica por los virus de la hepatitis B (VHB) y C (VHC). En función de este hallazgo, muchas organizaciones obstétricas y pediátricas han actualizado sus lineamientos sobre la detección y el manejo de la hepatitis en embarazadas y lactantes expuestos.
La hepatitis viral sigue siendo una de las infecciones virales más frecuentes y potencialmente graves del embarazo. Sin vacunación post natal e inmunoprofilaxis, la infección crónica por VHB ocurre en hasta el 90% de los lactantes infectados al nacer.
La mayoría de las infecciones crónicas por VHB son por transmisión vertical y, por lo tanto, la vacunación neonatal y la inmunoprofilaxis siguen siendo formas efectivas de reducir la infección neonatal, y la futura carga de infecciones crónicas por VHB. Las guías actuales sugieren que en todo embarazo deben realizarse pruebas de detección para VHB y VHC. La atención médica adecuada de la embarazada y del neonato puede reducir significativamente el riesgo de transmisión vertical.
REFERENCIAS:






