INTRODUCCIÓN
Se presenta el caso de un varón de 32 años sin factores de riesgo cardiovasculares conocidos y diagnóstico en 2016 de miocarditis aguda como único antecedente cardiológico que consulta por dolor torácico.
ANTECEDENTES PERSONALES
- No alergias medicamentosas conocidas.
- No factores de riesgo cardiovasculares conocidos.
- Niega hábitos tóxicos.
- Síndrome depresivo.
- Ingreso en 2016 en otro hospital por síncope situacional y dolor torácico. Al alta con
- diagnóstico de miocarditis aguda.
- Tratamiento habitual: fluoxetina 20 mg cada 12 horas.
Enfermedad Actual:
Varón de 32 años con los antecedentes personales previamente descritos que es traído a urgencias de nuestro hospital por desvanecimiento con pérdida de conocimiento no presenciada, coincidente con la defecación, y precedido de mareos y dolor torácico que ha continuado posteriormente tras recuperar el conocimiento. El paciente define el dolor torácico como opresivo, irradiado a garganta y sin cortejo vegetativo asociado, que ha cedido espontáneamente. Niega palpitaciones, no sensación disneica ni otra sintomatología asociada. El paciente refiere que el episodio es similar al que presentó en 2016 y que desde entonces no había presentado ningún cuadro similar. Niega empeoramiento de clase funcional y ningún otro tipo de sintomatología desde el punto de vista cardiológico. Realiza deporte de forma habitual y no ha presentado ninguna sintomatología infecciosa en días previos.
EXPLORACIÓN FÍSICA
Paciente estable con buen estado general. Eupneico en reposo, tolerando decúbito. Afebril y estable hemodinámicamente. Tensión arterial (TA) 115/70 mmHg, frecuencia cardiaca (FC) 58 lpm. Sin semiología congestiva. Auscultación cardiorrespiratoria con tonos rítmicos, sin soplos. Murmullo vesicular conservado sin otros ruidos sobreañadidos. Miembros inferiores sin edemas.
Pruebas Complementarias:
- Electrocardiograma (ECG) al ingreso (imagen 1): bradicardia sinusal a 49 lpm, eje normal, PR normal, QRS estrecho con tendencia a la elevación ST < 1 mm en colgadura en cara inferior, V5-V6.
- Radiografía de tórax: ICT en el límite superior de la normalidad. Senos costofrénicos libres.. No datos de congestión pulmonar. No imagen de neumotórax, ni consolidaciones.
- Analítica: glucosa 77 mg/dl, creatinina pico 1,34 mg/dl (previas normales, al alta normales), glucosa e iones en rango normal. Neutrofilia relativa sin leucocitosis. Hemoglobina 16,2 g/dl. Plaquetas 218.000. Coagulación sin alteraciones. TnTus 55 – 234 – 72,7 – 5,5 ng/l. CPK 127 – 136 – 121 mU/ml.
- Perfil lipídico: colesterol total 169 mg/dl, HDL 47 mg/dl, LDL 105 mg/dl, triglicéridos 84 mg/dl. LDL/HDL 2,2.
- Estudio de autoinmunidad negativo.
- Metabolismo del hierro: sideremia 106,4 microgramos/dl, transferrina 253 mg/dl, índice saturación transferrina 30%, ferritina 85 microgramos/litros.
- Ecocardiografía transtorácica (vídeos 1 y 2): aurícula izquierda de dimensiones normales (AP 37 mm, volumen 19 ml/m2). Válvula mitral normal, con velos sin afectación orgánica, no insuficiencia. Ventrículo izquierdo con volúmenes ligeramente aumentados (DTD 56 mm, DTDi 26 mm/m2, VTD 160 ml, VTDi 80 ml/m2, VTS 66 ml). FE 59% sin alteraciones segmentarias de la contractilidad. Grosor miocárdico normal, con septum de 8 mm y pared posterior de 8 mm. Patrón de llenado mitral normal con onda E 69 cm/s y onda A 38 cm/s. E’ septal 7 cm/s y E’ lateral 15,3 cm/s. Válvula aórtica trivalva, con velos anatómicamente normales, sin insuficiencia. Senos de Valsalva 36 mm. Ventrículo derecho de dimensiones y contractilidad normales. TAPSE de 22 mm, S’ tricúspide 12,7 cm/s. Insuficiencia tricuspídea trivial con Vmáx 2m/s. Insuficiencia pulmonar ligera. Vena cava inferior normal con adecuado colapso inspiratorio. Presión arteria pulmonar sistólica 19 mmHg. No derrame pericárdico.
- Angio-TAC coronarias (imágenes 2 y 3): calcio score Agastson de 1 (no existen placas identificables). Coronariografía a partir de los cortes axiales, reconstrucciones multiplanares, curvas y 3D: tronco común izquierdo que nace del seno coronario izquierdo, largo, de 21 mm de longitud y sin alteraciones significativas. Se bifurca en arteria descendente anterior (ADA) y circunfleja (ACx). ADA sin lesiones angiográficamente significativas, de buen desarrollo y calibre, que da múltiples ramas diagonales de pequeño calibre (hasta 3 ramas diagonales), todas ellas sin lesiones. ACx sin alteraciones angiográficamente significativas, que es de escaso calibre, pero casi en su origen da una rama Om1 de muy buen desarrollo y calibre, que tiene un trayecto proximal normal, pero todo su trayecto medio y distal sigue un recorrido intramiocárdico presentado un “puente intramiocárdcio de longitud significativa” y que en los cortes sistólicos presenta disminución de su calibre y fenómeno de compresión sistólica (coincide con la cara inferolateral ya que depende de la arteria circunfleja y del recorrido de una arteria OM). Arteria coronaria derecha (ACD) que nace del seno coronario derecho sin alteraciones angiográficamente significativas. Da dos ramas posterolaterales, pero no claramente da la rama descendente posterior o esta es una rama muy pequeña. Patrón de dominancia derecha. Conclusión: OM1 de muy buen desarrollo y calibre, que tiene un trayecto proximal normal, pero todo su trayecto medio y distal sigue un recorrido intramiocárdico presentando un “puente intramiocárdico de longitud significativa” y que en los cortes sistólicos presenta disminución de su calibre y fenómeno de compresión sistólica. El trayecto se ha calculado entre 7,5-8 cm. Resto de coronarias sin lesiones angiográficamente significativas, ni anomalías en su trayecto, ni disposición.
EVOLUCION
Tras documentarse en seriación enzimática en urgencias, discreta movilización enzimática con curva de isquemia (pico TNT Us: 234 ng/l) se decide ingreso en cardiología ante sospecha de nuevo episodio de miopericarditis dados sus antecedentes. El paciente durante su ingreso evoluciona favorablemente, no volviendo a presentar clínica de dolor torácico y no otra sintomatología.
Dado que la clínica no es característica de miopericarditis, por sus características y duración, ni presenta tampoco alteraciones eléctricas compatibles, con alteraciones en la cara inferior más sugerentes de etiología isquémica, así como el comportamiento de la seriación de fermentos cardiacos, con ascenso y caída muy rápida, nuevamente más características de perfil isquémico, se decide solicitar una prueba intermedia de detección de isquemia durante el ingreso como despistaje de enfermedad coronaria. Se realiza angio-TAC coronario que pone de manifiesto la existencia de un trayecto intramiocárdico de longitud significativa en la rama de OM1 y que en los cortes sistólicos presenta disminución de su calibre y fenómeno de compresión sistólica, siendo el resto de las coronarias normales. Dados los hallazgos, se considera que el cuadro de síncope vagal situacional con hipotensión asociada y la presencia del trayecto intramiocárdico de largo recorrido explicaría el cuadro de isquemia transitoria que motiva el ingreso. El paciente además aporta el informe de la resonancia magnética cardiaca (RMC) realizada en el ingreso anterior del 2016 que describe la presencia de realce leve de predominio subendocárdico en pared inferolateral, coincidente con el trayecto y podría explicarse por este mismo motivo.
Dada la buena evolución se deriva al paciente al alta con ácido acetilsalicílico (AAS) 100 mg cada 24 horas y amlodipino 5 mg cada 12 horas. Se recomienda evitar ejercicio de alta intensidad, sobre todo el de tipo isométrico (levantar pesas). El paciente es revisado en consultas externas 2 meses más tarde y permanece asintomático.
DIAGNÓSTICO
Infarto de miocardio con coronarias sin lesiones obstructivas (MINOCA) secundario a trayecto intramiocárdico importante de la arteria obtusa marginal con fenómeno de compresión sistólica.
DISCUSIÓN
El infarto agudo de miocardio (IAM) sin enfermedad coronaria aterosclerótica obstructiva o MINOCA (acrónimo inglés de Myocardial Infarction With no Obstructive Coronary Aterosclerosis) es un síndrome frecuente en la práctica clínica, ya que supone del 5 al 25% de todos los IAM1. La Sociedad Europea de Cardiología ha desarrollado el primer artículo de posicionamiento internacional sobre esta patología, definiendo los siguientes criterios diagnósticos1,2: 1) los
criterios IAM definidos por la “Cuarta definición universal de Infarto de miocardio; 2) ausencia de enfermedad coronaria obstructiva (sin lesiones ≥ 50% en un vaso epicárdico mayor; 3) ausencia de otra causa que pueda servir de causa alternativa. El pronóstico de este síndrome no es tan “benigno” como se pensaba y depende en gran medida de la etiología y las alteraciones cardiacas asociadas. Globalmente se ha descrito una tasa de mortalidad por todas las causas durante la hospitalización y a los 12 meses de entre el 0,1-2,2% y 2,2-4,7%, respectivamente2.
Sus causas son múltiples y pueden dividirse en: a) secundarias a alteraciones coronarias epicárdicas (p. ej., rotura de la placa ateroesclerótica, ulceración, fisuras, erosión o disección coronaria con enfermedad arterial coronaria [EAC] no obstructiva o sin EAC, IAM tipo 1); b) desequilibrio entre el aporte y la demanda de oxígeno (p. ej., espasmo y embolia coronaria, IAM tipo 2); c) disfunción endotelial coronaria (p. ej., espasmo microvascular, IAM tipo 2), y d) secundario a trastornos miocárdicos sin implicación de las arterias coronarias (p. ej., miocarditis o síndrome de tako-tsubo)3. La historia clínica, el electrocardiograma, las enzimas cardiacas, la ecocardiografía, la angiografía coronaria y la angiografía del ventrículo izquierdo representan las pruebas diagnósticas de primer nivel para identificar las causas de esta entidad. Las anomalías del movimiento de la pared regional en la ventriculografía izquierda limitadas a un solo territorio de una arteria coronaria epicárdica orientarían a un “patrón epicárdico”, mientras que las anomalías regionales de la contractildad que se extienden más allá de un solo territorio de una arteria coronaria epicárdica orientarían a un “patrón microvascular2,3.
Las arterias responsables del flujo coronario: descendente anterior, circunfleja y coronaria derecha tienen trayectos generalmente epicárdicos. En determinados pacientes, algunos segmentos de estas arterias principales se introducen en el espesor del músculo cardiaco, con trayectos intramiocárdicos de tamaño variable4. Estos segmentos intramiocárdicos están envueltos por haces de fibras musculares, que conforman los segmentos tunelizados. Atraviesan la porción intramural del miocardio para luego exteriorizarse hacia el epicardio y recibir el nombre de puentes o trayectos intramiocárdicos (PM). Estas anomalías congénitas coronarias se han conocido anatómicamente desde hace mucho tiempo y se producen por una falta de exteriorización de la primitiva red arterial intratrabecular coronaria. Se consideran tradicionalmente una condición benigna; aunque, la asociación entre isquemia miocárdica y la existencia de un trayecto ha incrementado su relevancia5. Aunque pueden encontrarse en cualquier arteria epicárdica, la mayoría de las veces ocurre en la descendente anterior. Los PM pueden producir, durante la sístole, una estenosis de la luz arterial mayor del 50%, conocido como “fenómeno de milking”, debido a la presión que ejercen las fibras miocárdicas sobre la arteria. Su incidencia en numerosas series angiográficas es de 0,6-4%; sin embargo, al estudiarse muestras de necropsia esta incidencia puede ser mucho mayor (34-52%)5,6. De esto se deduce que no todos los PM desencadenan fenómenos de milking angiográficamente significativos. Pero existen factores relacionados con el trayecto (profundidad, afectación de septales, otras arterias afectadas y el grado de reducción del diámetro sistólico) y con el paciente (edad, hipertrofia ventricular y aterosclerosis asociada) que pueden influir en la importancia clínica de este fenómeno.
El PM puede conllevar vasoespasmo coronario, trombosis y disección coronaria y por tanto el abanico clínico va desde la isquemia silente hasta la muerte súbita. Sin embargo, la alta prevalencia de este hallazgo anatómico (alrededor del 25% de la población) y baja probabilidad de síntomas del mismo, convierte en un gran reto demostrar la relación entre el trayecto y el espectro clínico atribuido al mismo. El milking suele ser considerado por muchos autores como una variante anatómica de la normalidad, con un buen pronóstico a largo plazo. A pesar de ser un fenómeno que afecta el flujo coronario, principalmente durante la sístole ventricular, y que las arterias coronarias perfunden predominantemente en diástole, los PM pueden afectar el flujo en ambas fases del ciclo cardiaco. Parece ser, además, que la compresión sistólica del vaso y el aumento de la presión en la zona del PM, estimulan que no se produzca un flujo adecuado durante el primer tercio de la diástole. También existe cierto grado de disminución de la luz diastólica del vaso, retraso en la relajación muscular, aumento de la velocidad del flujo coronario y el flujo retrógrado. Situaciones que traerían como resultado la disminución de la reserva de flujo coronario normal y la existencia de isquemia miocárdica; más frecuente en situaciones de mayor demanda (taquicardia, crisis hipertensiva y miocardiopatía hipertrófica)5,6.
No hay un método diagnóstico oro para el PM, actualmente se utilizan diferentes modalidades diagnósticas para evaluar su morfología y funcionalidad. Para la valoración anatómica, la tomografía computarizada coronaria (TC-coronario) ha mejorado el conocimiento y la caracterización de los PM ya que su capacidad 3D se asocia a una alta resolución espacial y de contraste. La RMC mejora la imagen de la anatomía coronaria, pero posee limitaciones en la resolución espacial, por lo cual no posee una visión intramiocárdica tan fiable6,7. En la coronariografía, el PM se presenta como un estrechamiento sistólico, y compresión diastólica parcial o completa. El estrechamiento sistólico puede acentuarse con la administración de nitroglicerina, la cual genera vasodilatación de los segmentos coronarios adyacentes. La imagen intravascular (IVUS) puede ser útil para mejorar la detección, caracterizar la longitud, el espesor y la localización del PM. Sin embargo, la valoración funcional es la pieza clave para la correlación entre el trayecto y clínica7. En la coronariografía, el PM conlleva un aumento artificial de la presión media utilizada en la reserva fraccional de flujo (FFR) tradicional y por lo tanto infraestima la importancia hemodinámica de la obstrucción. En este caso, el uso de FFR diastólica con dobutamina es más apropiado para valorar su repercusión hemodinámica. El iFR al ser un parámetro diastólico también podría ser una herramienta útil. En caso de no disponer de estas técnicas invasivas podemos utilizar técnicas de imagen como el eco de estrés, la gammagrafía o la resonancia magnética de estrés5-7.
Con respecto al tratamiento, el farmacológico es la base del tratamiento en pacientes sintomáticos. El objetivo principal del tratamiento médico debe enfocarse en disminuir los potenciales gatillos y alteraciones hemodinámicas que agravan el PM, como la hipertensión arterial, la hipertrofia ventricular izquierda, la taquicardia, la reducción del periodo de llenado coronario diastólico, y la inapropiada contractilidad y compresión de las arterias coronarias. Los betabloqueantes son la terapia de primera línea, debido a su efecto crono e inotrópico negativo, además de la reducción en el componente simpático. Los antagonistas de los canales de calcio pueden ofrecer un beneficio adicional concomitante sobre el vasoespasmo incrementado de los betabloqueantes, pero no hay estudios aleatorizados que comparen ambos tratamientos6,7. Habría que plantearse la antiagregación si existe enfermedad coronaria subclínica y evitar los vasodilatadores puros, debido a la compresión sistólica de la arteria tunelizada, taquicardia y dilatación proximal del vaso, lo cual puede agravar el flujo reverso en el segmento proximal al PM. La revascularización percutánea queda restringida, dada su alta tasa de complicaciones, a pacientes muy sintomáticos, refractarios a tratamiento médico y con contraindicación para la cirugía. La opción quirúrgica es la revascularización o la miotomía supra arterial. La revascularización quirúrgica en superior a la miotomía en casos de PM largos (> 25 mm) y profundos (> 5 mm). Los datos disponibles sugieres que el tratamiento quirúrgico es seguro y efectivo, y se recomienda en casos raros de pacientes gravemente sintomáticos refractarios al tratamiento médico, o cuando el tratamiento percutáneo falló o no se considera seguro8.
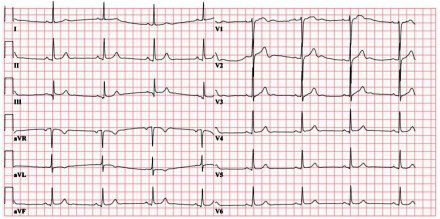
Imagen 1. ECG al ingreso: bradicardia sinusal a 49 lpm, eje normal; QRS estrecho con ST de morfología
ascendente en cara inferior y V5-V6.
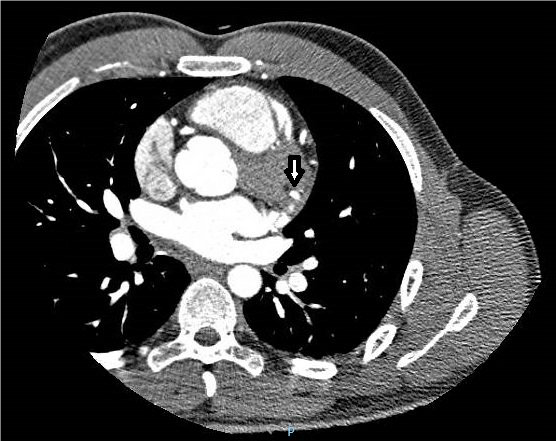
Imagen 2. TAC coronario: OM1 de muy buen desarrollo y calibre con trayecto medio y distal que sigue
un recorrido intramiocárdico.
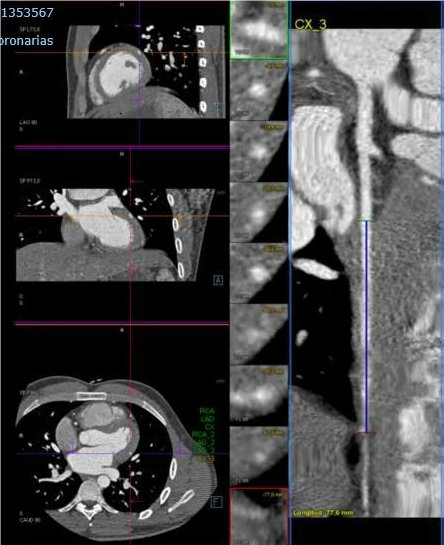
Imagen 3. TC coronario: reconstrucción del vaso donde se visualiza el trayecto medio y distal de OM1
con recorrido intramiocárdico de longitud significativa.
BIBLIOGRAFÍA
1. Tamis-Holland JE, Jneid H, Reynolds HR, Agewall S, Brilakis ES, Brown TM, et al. Contemporary Diagnosis and Management of Patients With Myocardial Infarction in the Absence of Obstructive Coronary Artery Disease: A Scientific Statement From the American Heart Association. 2019;139(18):e891-e908.
2. Niccoli G, Scalone G, Crea F. Acute myocardial infarction with no obstructive coronary atherosclerosis: mechanisms and management. European Heart Journal, Volume 36, Issue 8, 21 February 2015, Pages 475-481.
3. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Ibánez B, James S, Agewall S, Antunes MJ, Bucciarelli-Ducci C, Bueno H, Caforio ALP, Crea F, Goudevenos JA, Halvorsen S, Hindricks G, Kastrati A, Lenzen MJ, Prescott E, Roffi M, Valgimigli M, Varenhorst C, Vranckx P, Widimský P. Rev Esp Cardiol (Engl Ed). 2017Dec;70(12):1082.
4. Tarantini G, Migliore F, Cademartiri F, Fraccaro C, Iliceto S. Left Anterior Descending Artery Myocardial Bridging. J Am Coll Cardiol. 2016;68:2887-99.
5. MS Lee, CH Chen. Myocardial bridging: an up-to-date review. The Journal of invasive cardiology, 2015.