|
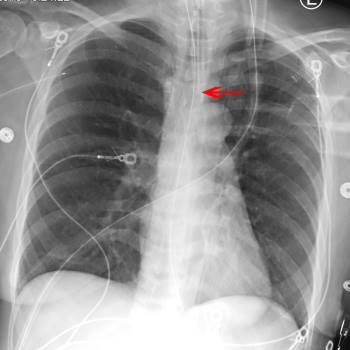
Caso 1: Varón de 87 años con antecedentes significativos de enfermedad pulmonar obstructiva crónica (EPOC), síndrome mielodisplásico complicado con anemia de enfermedad crónica, apnea obstructiva del sueño, injerto de derivación de arteria coronaria e intervenciones percutáneas coronarias por enfermedad arterial coronaria, con más de 1 año de historia de disnea de esfuerzo. Se presentó en el servicio de urgencias con 1 a 2 semanas de empeoramiento de la disnea de esfuerzo. El paciente afirma que su disnea empeora con cualquier movimiento. En el servicio de urgencias, sus signos vitales estaban estables y no había hipoxia en reposo pero, al ponerse de pie, se observó una desaturación abrupta de O2, en un oxímetro de pulso al 86% con aire ambiente. Los estudios de laboratorio mostraron un nivel de hemoglobina de 8,2 g/dl, por debajo de los 9,6 g/dl de 2 semanas antes. La radiografía de tórax y el ECG no mostraron procesos agudos. Se transfundió 1 unidad de concentrado de glóbulos rojos y fue internado en la sala de Clínica Médica para su manejo posterior. |
|
Caso 2: Niña de 2 años previamente sana con esquema de vacunación completo, fue atendida en el servicio de urgencias por presentar letargo, fiebre, rinorrea y disnea. En el examen, el color de piel y las mucosas era normal, sin aumento del trabajo respiratorio. Signos vitales notables: Frecuencia cardíaca 137/min. Frecuencia respiratoria: 23, Tº 37,8; SpO2 65% en aire ambiente, mejorado a 78% con máscara de no reinhalación de 15 litros. La auscultación pulmonar y los ruidos cardíacos eran normales, sin soplos y, por lo demás, un examen normal. Se realizó una análisis de gases en sangre arterial (GSA) que mostró una saturación de O2 (SO2) de 96% |
| ¿Qué es la hipoxia? |
La hipoxia aparece cuando los tejidos reciben una cantidad inadecuada de O2. Esto conduce a la interrupción de la función celular y puede ocurrir un cambio hacia el metabolismo anaeróbico y la subsiguiente acidosis láctica. Si bien el bajo contenido de O2 en la sangre, también conocido como hipoxemia, es una de las principales causas de hipoxia, no es la única.
| ¿Cuáles son las principales etiologías de la hipoxia? |
La hipoxia se puede dividir mejor en 4 categorías principales:
- Hipoxemia
- Hipoxia anémica
- Hipoxia isquémica/estancada
- Hipoxia histotóxica
| Hipoxemia |
Es la hipoxia que se refiere al estado de baja concentración de O2 en la sangre, y depende en gran medida de 5 factores clave:
- Altitud: a medida que la persona se desplaza a mayores altitudes, la presión barométrica cae, lo que lleva a la disminución de la cantidad de O2 inspirado, a pesar de una FiO2 estable. En la altitud extrema, el pulmón sano no contaría con suficiente O2 en el aire inspirado para ser suministrado adecuadamente al metabolismo tisular.
- Ventilación: La ventilación se refiere al suministro de gases a los alvéolos y está directamente relacionada con la eliminación de CO2. La hipoventilación conduce a la acumulación de CO2, disminución de la depuración de CO2 y la subsiguiente disminución de la concentración de O2 alveolar. En muchos procesos de enfermedad, un aumento en el CO2 en sí mismo puede generar un mayor trabajo respiratorio y se correlaciona con la distensibilidad pulmonar y la resistencia de las vías respiratorias. Por ejemplo, un paciente con una exacerbación aguda del asma tendrá una resistencia elevada en las vías respiratorias, lo que exacerbará el trabajo respiratorio.
- Difusión de oxígeno: es la capacidad del O2 para pasar por los alvéolos y rodear las membranas capilares de manera efectiva. El transporte puede verse afectado por un proceso patológico tisular primario, como en la fibrosis pulmonar.
- Coincidencia de ventilación/perfusión (V/Q): existe un equilibrio entre la oxigenación de los alvéolos y el flujo sanguíneo a través de sus capilares. La discrepancia entre estos dos factores aparecerá cuando la sangre fluya a través de los alvéolos con una ventilación inadecuada o no llegue a los alvéolos que tengan una ventilación adecuada. Ejemplos de esto son la embolia pulmonar, en la que se obstruye la perfusión y, el estado asmático, en el que el colapso de las vías respiratorias provoca atrapamiento de aire y obstrucción de la ventilación. El desajuste puede corregirse inhalando un exceso de O2, ya que incluso las áreas pulmonares mal ventiladas recibirán un flujo de O2 adecuado. Es importante tener en cuenta que, en estado normal, la coincidencia de ventilación/perfusión es heterogénea en diferentes áreas del pulmón, y que se exacerba bajo ciertas condiciones que afectan la falta de coincidencia V/Q (por ej., asma, neumonía).
- Derivación o cortocircuito de la sangre: se refiere al cortocircuito del proceso por el cual la sangre recibe oxigenación. En otras palabras, la sangre ingresa a la circulación sistémica antes de recibir la oxigenación adecuada. Los ejemplos clásicos de cortocircuito del torrente sanguíneo ocurren con defectos anatómicos como los del tabique interventricular. Otro ejemplo, es la presencia de un tapón mucoso en un bronquio principal, que impedirá que llegue O2 a los alvéolos y finalmente alcance la sangre. En cualquier caso, una fracción de O2 inspirado no llenará los alvéolos que están recibiendo la sangre, y por lo tanto, la hipoxemia no se corregirá.
| Hipoxia anémica |
La hipoxia puede ocurrir si la sangre tiene una capacidad de transporte de O2 críticamente baja.
Los cambios agudos en el nivel de hemoglobina (como la anemia por pérdida de sangre aguda y el shock hipovolémico) pueden provocar una disminución del transporte de O2 a los tejidos. La hipoxia también puede resultar de cambios en la funcionalidad de la hemoglobina, como en la intoxicación aguda por monóxido de carbono, donde hay muchas moléculas de hemoglobina que simplemente no pueden unirse al oxígeno.
| Hipoxia isquémica/estancada |
La hipoxia puede resultar de una disminución crítica del flujo de sangre oxigenada a los tejidos periféricos.
Condiciones sistémicas, como el shock cardiogénico, pueden provocar una disminución de la oxigenación de la sangre durante el intercambio gaseoso pulmonar, así como un suministro global inadecuado de sangre a los órganos centrales y periféricos. Las condiciones localizadas pueden impedir la difusión celular de O2 (como en el edema tisular grave) o impedir focalmente el flujo de sangre oxigenada (como en el daño u obstrucción arterial).
| Hipoxia histotóxica |
La hipoxia puede deberse a la baja utilización de O2 por los tejidos. Esto puede ocurrir con venenos celulares directos (sobredosis de cianuro, colchicina) o demanda anormalmente elevada de 02 tisular (neoplasia maligna).
| ¿Cuándo se debe sospechar hipoxia? |
Si bien no existe un valor de laboratorio único para medir directamente la hipoxia, debe ser sospechada en cualquier paciente con ansiedad, confusión e inquietud, que pueden ser signos tempranos de hipoxia y pueden preceder a los cambios en los signos vitales.
El sello distintivo de la hipoxemia es la SpO2 baja, una de las principales causas de hipoxia, y se puede sospechar en cualquier paciente con una saturación de O2 <90% (o <88% en pacientes con enfermedad pulmonar crónica).
La acidosis láctica se puede desarrollar en respuesta al metabolismo anaeróbico, por la hipoxia tisular o por aumento de la oleada de catecolaminas, y puede detectarse en la gasometría.
| Aproximación a la hipoxia |
1- Estabilidad del paciente: verificar el estado general y los signos vitales. La toma de decisiones para cualquier paciente en el servicio de urgencias es fundamental realizar una evaluación rápida pero exhaustiva para determinar si la persona está “enferma o no enferma”.
> Estado general
¿Cuál es el aspecto del paciente? ¿Está cómodo o en un estado de angustia aguda? ¿El paciente muestra algún comportamiento que pueda ser un signo clínico, por sutil que sea, de “anormalidad”?
> Evaluación de las vías aéreas, la respiración y la circulación
En cualquier paciente que pueda estar experimentando una enfermedad crítica (incluida la hipoxia) lo correcto es evaluar las vías respiratorias, la respiración y la circulación.
¿El paciente está protegiendo sus vías respiratorias? Aunque es raro, la hipoxia puede deberse a un estrechamiento crítico de las vías respiratorias dando lugar al estridor en la auscultación pulmonar. En los niños, la presencia de estridor laríngeo obliga a la búsqueda de una obstrucción de las vías respiratorias superiores. Se puede observar hipoxia por una lesión grave por inhalación de humo, que puede presentarse con estertores y ronquidos, y provocar un compromiso inminente de las vías respiratorias.
¿Los ruidos respiratorios están presentes bilateralmente?
Mientras que el neumotórax a tensión se asocia con síntomas clásicos de dificultad respiratoria y desviación traqueal, solo la mitad de los casos pueden presentarse con hipoxia franca.
¿La pared torácica sube y baja por igual?
Los pacientes con fracturas costales significativas que provocan una pared torácica inestable pueden tener una ventilación inadecuada y desarrollar hipoxia, así como hipercapnia y acidosis.
¿El paciente está taquicárdico? ¿Los pulsos distales están presentes?
Los pulsos filiformes pueden indicar pérdida de volumen intravascular. En el paciente con trauma cerrado, esto puede ser una manifestación de shock hemorrágico, siendo vital la reanimación, para prevenir la hipoxia tisular. En el paciente con infección grave, la taquicardia puede ser la manifestación de cambios de fluidos mediados por la inflamación y la subsiguiente hipoperfusión de los órganos diana y el daño isquémico.
> Signos vitales
En cualquier paciente inestable es crucial obtener un conjunto completo de signos vitales, que probablemente sean anormales y pueden ayudar a dilucidar la etiología subyacente de la inestabilidad del paciente.
Es más probable que la hipoxia aguda se manifieste con un aumento de la frecuencia respiratoria (>24) y un aumento de la frecuencia cardíaca (>100), pero la normalidad de la frecuencia respiratoria y la frecuencia cardíaca no debe excluir la posibilidad de hipoxia.
En enfermedades con hipoxemia e hipercapnia, además de la frecuencia respiratoria, el organismo intentará aumentar el volumen corriente con el objetivo de aumentar la ventilación alveolar. Los pacientes con pérdida brusca del volumen intravascular pueden desarrollar taquicardia e hipotensión y, a medida que empeora la hipovolemia, aumentando la frecuencia respiratoria para compensar la hipoxia tisular subsiguiente.
Los pacientes con hipotensión arterial pueden tener hipoxia por mala perfusión y justifica una pronta investigación de la causa subyacente. Los pacientes hipóxicos por shock séptico pueden ser hipertérmicos o hipotérmicos. Esto puede ser mejor identificado midiendo la temperatura central (como la temperatura rectal).
La lectura de la oximetría de pulso es propensa a imprecisiones, especialmente en pacientes inestables, y siempre debe ser considerada en un contexto clínico.
2- Historia y examen físico
En el paciente inestable, la historia puede ser limitada. Sin embargo, en el paciente estable es importante hacer una historia clínica y un examen físico completos, siendo éste el primer paso importante
¿El paciente tiene antecedentes de enfermedad cardíaca o pulmonar?
Los pacientes con enfermedad cardiovascular preexistente tienen más probabilidades de desarrollar una hipoperfusión de los órganos terminales y un estado hipóxico posterior.
Los pacientes con enfermedad pulmonar subyacente son propensos a desarrollar cambios fisiológicos que aumentan el riesgo de hipoxemia y la subsiguiente hipoxia, incluyendo disminución del impulso ventilatorio, procesos obstructivos de las vías respiratorias, exudados intraalveolares, engrosamiento del tabique alveolar, inflamación y fibrosis, y daño alveolocapilar.
¿Hay antecedentes de tabaquismo?
El tabaquismo se asocia con mayor riesgo de hipoxia, por la alteración fisiológica de la función pulmonar. Los niveles de monóxido de carbono en sangre suelen estar elevados en los fumadores crónicos, en quienes se han informado elevaciones graves y síntomas de hipoxia.
¿Cirugías recientes?
En el postoperatorio, los pacientes están más propensos a sufrir atelectasias, neumonía y embolismo pulmonar, patologías que pueden cursar con hipoxia.
Revisión de sistemas: muchos pacientes con hipoxia presentan disnea o aumento del trabajo respiratorio, pero también confusión o sensación de lentitud. La cefalea puede ser el único síntoma de hipoxia en pacientes con intoxicación aguda por monóxido de carbono (CO.
> Examen físico
El aspecto general del paciente puede orientar sobre la etiología.
- La cianosis puede aparecer primero en los labios y en la punta de los dedos distales y ser un signo de hipoxemia grave. La decoloración cutánea difusa, opaca y roja puede ser un signo de toxicidad por cianuro.
- La palidez puede ser un signo de anemia por pérdida de sangre aguda.
- Los estertores crepitantes en la auscultación pulmonar pueden indicar insuficiencia cardíaca si es bilateral o neumonía lobar si es focal y unilateral.
- La ausencia de sonidos respiratorios puede indicar un derrame o un colapso pulmonar.
- Las extremidades distales pueden estar calientes en el shock distributivo o frías y pegajosas en un paciente con hemorragia.
- La piel y las mucosas de color rojo cereza son hallazgos post mortem habituales en la intoxicación, de hecho, son poco frecuentes en la presentación.
- El paciente puede estar alterado e inquieto en el examen neurológico.
La aparición macroscópica de sangre en el examen rectal puede indicar anemia por pérdida aguda de sangre.
3- Evaluación adicional
> Saturación arterial de O2 (SaO2).
La SaO2 describe la cantidad de O2 unido a la hemoglobina, y los valores normales oscilan entre 95% y 100%.
Un medio rápido de evaluar esto es con oximetría de pulso. Basándose en la absorción conocida de luz en longitudes de onda particulares de sangre oxigenada y desoxigenada, la oximetría de pulso utiliza la espectrofotometría para calcular la SaO2 estimada (SpO2). La precisión de esta medición depende en parte de la fuerza precisa de la señal traducida en forma de onda y que normalmente debería ser nítida, con una muesca dicrótica clara.
Los estados de baja perfusión tendrán formas de onda sinusal de baja amplitud. En estos pacientes (como aquellos con gasto cardíaco bajo, vasoconstricción periférica o hipotermia), las mediciones de la SpO2 deben tomarse con precaución.
Las lecturas de la SpO2 también deben tomarse con precaución en pacientes con esmalte de uñas, que puede interferir significativamente con la absorción de luz en las longitudes de onda utilizadas por la oximetría de pulso, así como en pacientes con pigmentación de piel más oscura.
Es importante tener en cuenta que la SpO2 suele ser inexacta en pacientes con intoxicación por CO. De hecho, dado que la oxihemoglobina y la carboxihemoglobina tienen propiedades de absorción similares para la luz roja, en pacientes con envenenamiento por CO; la oximetría de pulso a menudo estimará la SaO2 verdadera como normal o falsamente elevada; esta propiedad de absorción es también la razón por la cual los pacientes con intoxicación por CO presentan color rojo cereza.
La metahemoglobinemia es otra enfermedad en la que sus propiedades de absorción de la luz roja harán que la oximetría de pulso no sea confiable y es la razón por la cual una toxicidad significativa suele cambiar las estimaciones de SaO2 de la oximetría de pulso, cercana al 85%.
También hay que tener cuidado al usar la oximetría de pulso para medir la tendencia de la SO2 en pacientes en estado crítico, en quienes se ha demostrado que los efectos de la acidosis y la anemia interfieren con la correlación de las estimaciones de la oximetría de pulso y la SaO2 verdadera.
Los oxímetros de pulso nuevos, de múltiples longitudes de onda, diseñados para medir la metahemoglobina y la carboxihemoglobina, pueden mejorar las capacidades futuras del monitoreo del O2.
> Análisis de gases en sangre arterial (GSA)
El análisis de GSA proporciona información sobre la ventilación alveolar, la oxigenación y el equilibrio ácido-base.
En la evaluación de estos procesos fisiológicos clave, los GSA miden la presión parcial de O2 arterial (PaO2) y de CO2 (PaCO2) y, en comparación con la oximetría de pulso, es una herramienta más definitiva para evaluar la oxigenación y la ventilación. La PaO2 normal se halla entre 80 y 100 mmHg y, como causa de la hipoxemia, los valores inferiores pueden indicar hipoxia. El conocimiento de su valor también es útil en el manejo de pacientes con soporte ventilatorio.
La PaCO2 normal se considera de 35 a 45 mmHg, y sus niveles pueden estar elevados en situaciones de aumento del metabolismo o disminución de la ventilación; en cualquier caso, la agudeza de la hipercapnia se puede evaluar sobre la base de cualquier cambio concurrente en el ion bicarbonato (HCO3).
Las elevaciones de la PaCO2 con respecto al valor inicial en la dificultad respiratoria asociada al aumento del trabajo respiratorio pueden indicar insuficiencia respiratoria y servir como indicación para soporte ventilatorio. Mientras que la mayoría de los análisis de GSA miden directamente el pH y la PaCO2, los cambios de las bases y el HCO3 se calculan indirectamente; especialmente en pacientes críticos. Estos últimos cálculos pueden ser muy variables y deben interpretarse con cautela.
Esta medición rápida y directa del pH puede ser fundamental en pacientes con trastornos metabólicos, como sepsis grave, cetoacidosis diabética y alcohólica, traumatismo, insuficiencia respiratoria aguda, paro cardíaco y EPOC. En estas situaciones, el análisis de gases en sangre venosa (GSV), que puede ser el preferido clínicamente, por numerosas razones, también es confiable.
Es imperativo interpretar siempre los GSA dentro del contexto clínico del paciente.
La precisión de los datos recopilados a partir de una muestra de GSA es particularmente susceptible a errores, y se debe tener cuidado para confirmar que la muestra de sangre es realmente de naturaleza arterial (y no venosa), eliminar completa y rápidamente cualquier burbuja de aire, inspeccionar si hay coágulos, y que la muestra sea analizada dentro de los 30 minutos de la hora de recolección.
Las muestras de GSA son aún más propensas a errores en pacientes con PaO2 elevada, como aquellos con niveles elevados de O2 suplementario o en quienes se sospecha una fisiología de cortocircuito arterial, así como pacientes con leucocitosis o trombocitosis. El análisis de GSA se debe realizar dentro de los 5 minutos.
> Análisis de gas en sangre venosa (GSVV)
En comparación con los GSA, la punción para GSV suele ser más rápida de realizar, menos dolorosa y conlleva un riesgo más bajo de complicaciones, como lesión y trombosis arteriales. Debido a estos beneficios potenciales, al establecer el estado ácido-base y evaluar la función respiratoria en el servicio de urgencias, se debe considerar el análisis de GSV. Este análisis no es inferior en su capacidad para detectar anomalías ácido-base en enfermedades críticas como la enfermedad arterial coronaria y las exacerbaciones agudas de la EPOC.
Se debe tener precaución en caso de compromiso hemodinámico grave, como en el shock grave o un paro cardíaco, cuando se ha demostrado que el análisis de lactato y pH en sangre venosa es menos confiable.
Por otra parte, si bien GSV puede ser útil en la detección de la hipercarbia arterial, tiene una correlación deficiente con los resultados de los GSA en el análisis de la pO2 y la pCO2, y es demasiado impredecible clínicamente.
> Imágenes
Las imágenes del tórax pueden ayudar a determinar la causa subyacente de la hipoxia.
La radiografía de tórax puede ser útil para diagnosticar alteraciones focales de las vías respiratorias, como neumonía, síndrome de dificultad respiratoria aguda, hiperinsuflación pulmonar y edema pulmonar. Una radiografía de tórax inicial no siempre puede dilucidar una etiología subyacente.
La tomografía computarizada tórax puede ser útil para brindar más detalles. La evidencia de lesión por inhalación de humo puede estar ausente en la radiografía de tórax inicial, pero servirá como evaluación inicial en tales casos.
| Diagnóstico diferencial de la hipoxia |
> Caso 1
Este paciente tenía el síndrome platipnea-ortodesoxia (SPO), una enfermedad caracterizada por disnea posicional (platipnea) e hipoxemia en posición erguida (ortodesoxia). A diferencia de la ortopnea, se alivia al acostarse. Su causa subyacente fue el cortocircuito de la sangre a través de un foramen oval permeable, que es la causa más común del SPO. En general, el SPO se presenta en pacientes ancianos con defectos anatómicos cardíacos que más adelante en la vida han desarrollado nuevas anomalías anatómicas o funcionales secundarias, que conducen a una fisiología de cortocircuito sanguíneo clínicamente significativo, y a la subsiguiente hipoxemia. Este caso destaca la necesidad de mantener un elevado nivel de sospecha en los casos refractarios al tratamiento estándar.
> Caso 2:
Esta paciente tenía metahemoglobinemia congénita, que no fue evidente al nacer debido al fenómeno de cambio de hemoglobina. Por lo demás, las personas sanas tienen una pequeña cantidad de metahemoglobina. Esta enfermedad se caracteriza por una deficiencia en la citocromo b5 reductasa (b5R), que altera la vía bioquímica responsable de reducir la metahemoglobina a hemoglobina normal en la sangre. Se observó que la paciente tenía un progenitor con una enfermedad similar. Se debe sospechar metahemoglobinemia en cualquier paciente con cianosis y SpO2 anormal que no responde al O2 suplementario. No siempre se detecta mediante la oximetría de pulso y requiere un análisis de GSA, el cual demostró una concentración de metahemoglobina del 10,6%. El diagnóstico formal se realiza con la secuenciación del ADN. El tratamiento primario de la metahemoglobinemia es el azul de metileno y debe administrarse 1-2 mg/kg IV.